Hukum Termodinamika
Termodinamika (berasal dari kata thermos (panas) dan dynamic (gerak atau perubahan)) adalah salah satu cabang dari ilmu fisika
yang mempelajari panas dan temperatur, serta hubungan keduanya pada
energi dan gerak. Inti dari pembahasan termodinamika adalah bagaimana
energi dalam bentuk panas dapat mengalir dari satu benda ke benda lain,
proses dari aliran energi tersebut, dan akibat yang dihasikan oleh
perpindahan energi tersebut.
Pada termodinamika, terdapat 4 hukum yang berlaku secara universal.
Hukum termodinamika 0 menjelaskan kesetimbangan termal berlaku universal, dengan kata lain apapun zat atau materi benda akan memiliki kesetimbangan termal yang sama bila disatukan.
 Dimana
Dimana 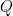 adalah kalor/panas yang diterima/dilepas (J),
adalah kalor/panas yang diterima/dilepas (J),  adalah energi/usaha (J), dan
adalah energi/usaha (J), dan  adalah perubahan energi (J). J adalah satuan internasional untuk energi atau usaha,
yaitu Joule. Dari persamaan tersebut dapat diketahui bahwa seluruh
kalor yang diterima atau dilepas oleh benda akan dijadikan usaha
ditambahkan dengan perubahan energi.
adalah perubahan energi (J). J adalah satuan internasional untuk energi atau usaha,
yaitu Joule. Dari persamaan tersebut dapat diketahui bahwa seluruh
kalor yang diterima atau dilepas oleh benda akan dijadikan usaha
ditambahkan dengan perubahan energi.
 ). Nilai usaha dapat dihitung dengan persamaan berikut.
). Nilai usaha dapat dihitung dengan persamaan berikut.
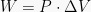 Dari rumus tersebut, diketahui juga bahwa apabila volume membesar
(terjadi pemuaian) maka usaha bernilai positif, dan bila volume mengecil
(terjadi penyusutan) maka usaha bernilai negatif.
Dari rumus tersebut, diketahui juga bahwa apabila volume membesar
(terjadi pemuaian) maka usaha bernilai positif, dan bila volume mengecil
(terjadi penyusutan) maka usaha bernilai negatif.

 ). Pada proses ini, nilai usaha adalah 0 karena tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.
). Pada proses ini, nilai usaha adalah 0 karena tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.

 ).
).
 Nilai usaha pada proses isotermik dinyatakan dengan persamaan berikut:
Nilai usaha pada proses isotermik dinyatakan dengan persamaan berikut:
 Dimana n adalah jumlah zat yang dinyatakan dengan satuan mol, R
adalah konstanta gas, dan T adalah suhu. Rumus ini didapatkan dengan
menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal.
Dimana n adalah jumlah zat yang dinyatakan dengan satuan mol, R
adalah konstanta gas, dan T adalah suhu. Rumus ini didapatkan dengan
menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal.
 ).
).
 Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik dapat dinyatakan dengan persamaan:
Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik dapat dinyatakan dengan persamaan:
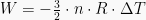 Jika diperhatikan dengan sekilas, proses adiabatik dan isotermik
memiliki diagram P-V yang serupa. Secara detil, dapat dilihat bahwa
proses adiabatik memiliki kemiringan yang lebih curam dibandingkan
proses isotermik seperti contoh grafik berikut.
Jika diperhatikan dengan sekilas, proses adiabatik dan isotermik
memiliki diagram P-V yang serupa. Secara detil, dapat dilihat bahwa
proses adiabatik memiliki kemiringan yang lebih curam dibandingkan
proses isotermik seperti contoh grafik berikut.
 Jika semua proses tersebut digambarkan menjadi suatu diagram P-V,
dapat didapatkan grafik berikut. Patut diingat bahwa satuan-satuan yang
digunakan dalam perhitungan adalah Satuan Internasional. Sebagai contoh,
satuan untuk suhu yang digunakan adalah Kelvin, satuan untuk volume adalah m3, dan satuan untuk jumlah zat adalah mol.
Jika semua proses tersebut digambarkan menjadi suatu diagram P-V,
dapat didapatkan grafik berikut. Patut diingat bahwa satuan-satuan yang
digunakan dalam perhitungan adalah Satuan Internasional. Sebagai contoh,
satuan untuk suhu yang digunakan adalah Kelvin, satuan untuk volume adalah m3, dan satuan untuk jumlah zat adalah mol.

Pada termodinamika, terdapat 4 hukum yang berlaku secara universal.
Hukum termodinamika 0 menjelaskan kesetimbangan termal berlaku universal, dengan kata lain apapun zat atau materi benda akan memiliki kesetimbangan termal yang sama bila disatukan.
“Jika dua sistem berada dalam
kesetimbangan termal dengan sistem ketiga, maka mereka berada dalam
kesetimbangan termal satu sama lain”
Hukum Termodinamika 1
Hukum termodinamika 1 menunjukkan hukum kekekalan energi.
“Energi tidak dapat diciptakan ataupun dimusnahkan, melainkan hanya bisa diubah bentuknya saja”
Terdapat persamaan matematik yang menjelaskan hukum ini, yaitu:Hukum 2 Termodinamika
Hukum 2 termodinamika menunjukkan kondisi alami dari alur kalor suatu objek dengan sistem.
“Kalor mengalir secara alami dari benda
yang panas ke benda yang dingin; kalor tidak akan mengalir secara
spontan dari benda dingin ke benda panas tanpa dilakukan usaha”
Hukum Termodinamika 3
“Entropi dari suatu kristal sempurna pada absolut nol adalah sama dengan nol,”
Proses-proses Termodinamika
Proses termodinamika terbagi menjadi empat macam, tergantung dari keadaan tekanan, volume, dan suhu saat terjadinya proses tersebut. Proses-proses tersebut umumnya digambarkan dalam diagram P-V, yaitu diagram yang menggambarkan tekanan (P) dan volume (V) saat proses terjadi. Ada dua hal penting yang harus diingat dari berbagai jenis proses-proses termodinamika, yaitu variabel yang berubah dan usaha yang dilakukan. Usaha yang terjadi pada suatu proses termodinamika dapat diketahui dengan menghitung luasan grafik P-V.Isobarik
Isobarik adalah proses termodinamika yang tidak mengubah nilai tekanan sistem (
Sumber gambar: figures.boundless-cdn.com
Isokhorik
Isokhorik adalah proses termodinamika yang tidak mengubah nilai volume sistem (
Sumber gambar: cft.fis.uc.pt
Isotermik
Isotermik adalah proses termodinamika yang tidak mengubah nilai suhu sistem (
Sumber gambar: bu.edu
Adibatik
Adiabatik adalah proses termodinamika yang tidak mengubah nilai kalor sistem (
Sumber gambar: gsu.edu

i.stack.imgur.com

kias.dyndns.org
Post a Comment for "Hukum Termodinamika"
Kata Pengunjung: